Accasciarsi sul letto, immergersi nella morbidezza delle coperte, rilasciare mente, pensieri, preoccupazioni. Dormire, attività fondamentale per ristabilire l’equilibrio psicofisico, così importante e quotidiana da risultare scontata. Ma non a tutti è concesso di lasciarsi cullare dalle braccia di Morfeo, non tutti rallentano il respiro e riposano: per alcuni ogni notte potrebbe essere l’ultima, a causa delle asfissianti spire di Ondina.
«Tu mi hai giurato fedeltà con ogni tuo respiro, e io ho accettato il tuo voto. Così sia. Finché sarai sveglio, potrai avere il tuo respiro, ma dovessi mai cadere addormentato, allora esso ti sarà tolto e tu morirai!»
La maledizione di Ondina (o ipoventilazione alveolare primitiva) è una malattia molto rara in cui si verifica una disfunzione della parte di sistema nervoso centrale deputata alla ventilazione (ovvero il trasporto di aria nelle vie aeree); ciò fa sì che si perda il riflesso involontario dell’atto ventilatorio, col risultato di non poter essere in grado di respirare appropriatamente durante il sonno, fino a rischiare di morire. È una patologia che colpisce soprattutto neonati (se congenita) ma, in certi casi, può interessare anche l’adulto dando luogo a una sintomatologia ancor più drammatica. In Italia è stata diagnosticata per la prima volta negli anni ‘70.
La leggenda e la tragedia
Com’è facilmente intuibile, il nome (estremamente evocativo) della malattia è tratto dal mondo della mitologia. Secondo la cultura germanica Ondina, figlia del Re del Mare (non a caso Ariel, la più famosa sirenetta, sarà in parte ispirata proprio da questa leggenda), era un ninfa a dir poco bellissima e con il desiderio di trovare una dolce metà con cui avere un erede. Un desiderio abbastanza egoista, in realtà: Ondina, essendo una ninfa, era per definizione immortale, ma tale condizione veniva vissuta dalla stessa nereide come una subacquea ed eterna condanna all’apatia – a meno che non avesse trovato un amore terrestre da cui avere un figlio. Mossa dunque da questa aspirazione, Ondina decise di abbandonare il suo ambiente. Ritrovatasi bambina sulla terra (era ciò che accadeva alle ninfe che abbandonavano il loro ambiente natìo, secondo la tradizione), venne accolta e cresciuta da un pescatore e da sua moglie. Divenuta grande, conobbe il cavaliere Hulbrand. Un vero colpo di fulmine, così potente da far invaghire anche il giovane uomo. I due, da copione, si sposarono nel giro di poco tempo. Tutto sembrava andare alla perfezione, tanto che Hulbrand, persino dopo essere venuto a conoscenza della vera natura di Ondina, arrivò a prometterle amore “fino all’ultimo respiro”. Lo zio di Ondina, Kuhleborn, mise quest’ultima in guardia: se mai avesse subito un torto da Hulbrand, lei sarebbe dovuta tornare alla vita sottomarina per sempre e lui sarebbe dovuto morire.

Il momento di krisis di questa storia sopraggiunse quando una vecchia fiamma di Hulbrand tornò dall’uomo per sedurlo, riuscendoci. Questo fatto segnò il destino di entrambi: gli spiriti dell’acqua pretesero la loro vendetta, asserendo che sarebbe dovuta essere proprio Ondina a uccidere Hulbrand. E qui ritorniamo alla frase riportata all’inizio: quella di Ondina fu una vendetta da vera femme fatale ante litteram, con un bacio maledetto dal retrogusto di condanna, tale da impedire al marito di addormentarsi, pena la morte.
Meccanismi della perdita del respiro
Come già ampiamente accennato in precedenza, il tratto chiave della malattia è l’ipoventilazione notturna: se durante la veglia c’è una respirazione normale, quello che a cui si assiste soprattutto durante la fase NREM del sonno (già spiegata negli articoli precedenti) è un rallentamento del normale riflesso ventilatorio, una riduzione (progressiva o improvvisa) del normale alternarsi di inspirazione ed espirazione.
Per capire bene il quadro clinico che ne deriva, è necessario chiarire il funzionamento del processo respiratorio e i suoi meccanismi. È certamente lapalissiana la differenza che sussiste tra respirazione volontaria e involontaria, essendo queste esperienze comuni: da un punto di vista neurofisiologico, la prima è permessa dall’attività della corteccia cerebrale, mentre la seconda ha origine a livello dell’ipotalamo (regione del sistema nervoso centrale localizzata nella zona centrale tra i due emisferi cerebrali, al di sotto di quella porzione chiamata del talamo – come suggerisce la stessa etimologia) grazie a neuroni dotati di intrinseche proprietà di attivazione elettrica. Questi due sistemi, grazie a specifici collegamenti sinaptici convergono a livello del tronco encefalico (la zona del sistema nervoso centrale tra encefalo e midollo), ove vanno a formare un vera e propria rete di sinapsi collegate al midollo, dal quale originano gli assoni (ovvero le estroflessioni dei neuroni partecipanti alle sinapsi) costituenti i nervi che controllano i muscoli primari e secondari della respirazione [vedi immagine]. Ovviamente questo sistema è modulabile in relazione alle modificazioni delle concentrazioni di ossigeno e anidride carbonica presenti nel sangue, grazie all’attività di alcuni recettori presenti in alcune arterie.
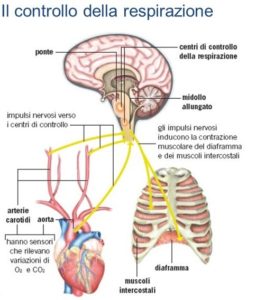
Con la malattia viene meno la funzionalità intrinseca delle cellule ipotalamiche, le quali non possono nemmeno essere attivate (collateralmente e secondariamente) dall’attività elettrica dei neuroni corticali deputati alla respirazione volontaria. Tutto questo dunque implica che quando si dorme o si perde conoscenza, non si attivano i riflessi involontari per ventilare. Ciò comporta necessariamente un calo del fisiologico e indispensabile trasporto di aria attraverso le vie aeree, da cui ne segue come effetto immediato la diminuzione del ricambio di aria a livello polmonare. Quanto appena illustrato si traduce in una modificazione delle normali concentrazioni di gas in arterie e vene, in quanto nel sangue risulta esservi meno ossigeno e più anidride carbonica rispetto alle condizioni fisiologicamente tollerate. La logica conseguenza di questa cascata di eventi è la diminuzione dell’ossigenazione dei tessuti, cosa che provoca sofferenza negli organi, mancamenti, fino alla cessazione del respiro.
Manifestazione della malattia
Prevedibilmente, le conseguenze di questa asfissia riguardano l’intero organismo, con una gravità variabile secondo l’entità della malattia. In modo particolare, la riduzione acuta del meccanismo del respiro può portare ad alterazioni cardiache, con modificazioni irregolari del ritmo che possono dare luogo a vertigini, perdite transitorie di conoscenza, cianosi e tremori fino ad arresti cardiaci potenzialmente fatali (non a caso la malattia rappresenta una delle possibili cause di morte improvvisa del neonato). Anche l’intestino, lo stomaco e tutto l’apparato digestivo riportano danni più o meno importanti che vanno dall’inappetenza accompagnata da stipsi e difficoltà nella deglutizione alla costipazione cronica con dilatazione dell’addome (soprattutto quando la ipoventilazione è accompagnata dalla malattia di Hirschsprung, come verrà detto sotto). Tuttavia a subire in cronico i danni maggiori è il sistema nervoso centrale, soprattutto quando la malattia si manifesta nei primi mesi dopo la nascita: difatti, essendo questo periodo della vita fondamentale per il neurosviluppo, i bambini presenteranno deficit cognitivi e sensoriali, con difficoltà di apprendimento, problemi uditivi, strabismo, epilessia. Oltretutto (rispetto ai bambini non affetti) sono più comuni episodi di spasmi affettivi con colorito blu, ovvero condizioni di apnea transitoria e cianosi innescate da rabbia, dolore o paura. Peraltro, sembra aumentato anche il rischio di insorgenza di neoplasie a livello del sistema nervoso centrale (sia benigne che maligne).
Quali sono le cause?
Nei neonati, la causa principale si riscontra in una mutazione genetica di un particolare gene codificante per una proteina del tessuto nervoso. In realtà le mutazioni possibili sono diverse e possono riguardare più cromosomi, anche se nella maggior parte dei casi il gene coinvolto è PHOX2B, contenuto nel cromosoma 4. Tale gene codifica per una proteina responsabile dello sviluppo del tessuto cerebrale durante la formazione dell’embrione, vale a dire prima delle 8 settimane di gravidanza (esperimenti effettuati su cavie da laboratorio in cui era stata indotta questa condizione hanno rilevato la non sopravvivenza delle stesse cavie). Si ritiene verosimile che nella maggior parte dei casi la mutazione insorga spontaneamente durante la vita intrauterina e non venga dunque trasmessa da uno dei genitori. Tale proteina si ritrova attiva e funzionante in molti neuroni (in termini medici si parla si neurocristopatia, ovvero di anomalia dello sviluppo delle cellule nervose provenienti da quella parte dell’embrione chiamata “cresta neurale”) e un suo malfunzionamento può essere anche alla base di altre patologie che rendono la maledizione un vero supplizio: tra queste si ricordano la malattia di Hirschsprung (malformazione congenita riguardante l’innervazione della parte terminale del colon, che comporta una quasi totale immobilità da parte dell’intestino con conseguente accumulo di feci e dilatazione massiva del colon stesso – megacolon) e il neuroblastoma (tumore pediatrico originante dalle cellule del sistema nervoso autonomo). Per i bambini, quindi, il sospetto diagnostico viene prima posto sulla base della clinica e solo poi confermato con appositi test genetici eseguiti in centri specializzati. Nell’adulto, la malattia può insorgere non come patologia primaria bensì come danno secondario a accidenti cerebrovascolari, i quali danneggiano in maniera gravissima (e spesso irreparabile) i centri nervosi del respiro. Più raramente ciò può avvenire in conseguenza di danni al midollo spinale.
Terapia, assistenza e ricerca
Questa condizione non ha una cura che ne garantisca la guarigione allo stato attuale dell’arte, quasi a voler dimostrare la potenza della ninfa, come se oltre al danno debba esservi per forza una associata beffa. È doveroso però osservare che la ricerca medica ha fatto passi da gigante nell’assistenza medica di tali pazienti, perché se trent’anni fa uno sventurato “maledetto” era costretto a vivere un’esistenza non proprio soddisfacente all’interno del polmone d’acciaio (un vecchio respiratore a pressione negativa, utilizzato moltissimo anche per i malati di poliomielite), oggi i pazienti hanno a loro disposizione diversi devices che permettono di preservare un minimo ma dignitoso grado di qualità di vita. In particolar modo, tali pazienti possono usare
• il ventilatore, molto utilizzato soprattutto nei bambini piccoli nella misura in cui è il dispositivo più facile da installare, seppur richieda una tracheotomia;
• maschere per la ventilazione BiPAP, CPAP;
• pacemaker interni che, impiantati a livello della lesione neuronale, emettono impulsi i quali permettono al diaframma di contrarsi.
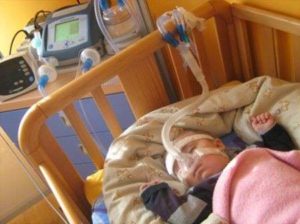
Da ultimo bisogna ricordare che esistono specifici centri di riferimento per questa particolare categoria di pazienti, i quali oltre a permettere ai malati di respirare, rendono possibile un miglioramento della loro quotidianità in tutti i suoi aspetti. La strada è ancora lunga e tutta in salita, ma l’affanno si riduce sempre di più.
